植物营养是植物所有组织和器官生长和发育的物质基础,它们除了可以为植物提供所需的各种结构物质外,也可以作为信号分子参与调控植物多方面重要的功能,包括但不限于植物细胞分裂和生长、发育、衰老以及对环境信号的响应等过程。雷帕霉素靶蛋白(Target of Rapamycin, TOR)是一个在真核生物中高度保守的丝氨酸/苏氨酸蛋白激酶。近20多年来的研究发现TOR可以整合营养、激素及多种逆境信号,调控蛋白质翻译,细胞自噬及代谢等过程从而促进细胞的生长和分裂以及胁迫响应。在哺乳动物中,TOR与生理、代谢息息相关,在衰老和多种疾病中起着至关重要的作用,因而成为近年来全球关注的研究热点1,2。与传统蛋白质翻译调控机制不同的是,熊延团队前期研究发现植物TOR激酶可以感受糖营养能量信号,直接促进细胞分裂周期关键转录因子E2Fa/b的活性,激活S-期基因表达来调控植物根尖和茎尖细胞的分裂和生长3,4。但植物糖-TOR信号通路如何调控整个基因转录组重编程的分子机制却仍然是个迷。

近日,英国威廉希尔公司熊延教授团队在Nature在线发表了题为The TOR–EIN2 axis mediates nuclear signalling to modulate plant growth的研究论文,该研究发现乙烯信号通路中的关键蛋白EIN2是糖-TOR信号通路调控基因转录组重编程的重要下游元件。TOR直接磷酸化EIN2并抑制EIN2全长蛋白的质-核穿梭,阻止EIN2在细胞核内抑制细胞分裂和伸长相关基因的表达,从而促进植物细胞的分裂和伸长。令人惊奇的是,该研究发现EIN2参与糖-TOR信号通路与其参与传统的乙烯-CTR1信号通路是相分开的,首次揭示了EIN2 独立于乙烯信号通路的新分子机制和功能。
为了解析糖-TOR信号下游如何调控植物细胞生长的分子机制,该研究团队通过遗传学和化学遗传学手段筛选和鉴定到参与乙烯信号通路的关键组分EIN2及EIN3/EIL1的突变体可以部分拮抗TOR激酶失活抑制下胚轴细胞伸长的表型。进一步研究发现EIN2及EIN3/EIL1介导的糖-TOR调控下胚轴细胞伸长并不依赖于乙烯受体ETR1,并且该过程也不受乙烯合成抑制剂AVG及感受抑制剂1-MCP的影响。生化分析证明TOR激酶可以直接和EIN2蛋白互作并磷酸化EIN2,而EIN3/EIL1-ERFs则作为TOR-EIN2的下游组分调控下胚轴的伸长,从而明确了EIN2独立于乙烯信号通路参与糖-TOR信号调控细胞伸长的新功能。
该研究进一步发现,TOR激酶可以磷酸化EIN2-Thr657位点,并抑制EIN2全长蛋白的质-核穿梭,糖饥饿或TOR激酶受抑制时,EIN2-Thr657磷酸化位点被去除,导致EIN2以全长蛋白的形式在细胞核内富集,从而诱导糖-TOR信号相关的下游基因转录变化,并抑制下胚轴的伸长。与此对应的是,乙烯-CTR1信号通路中CTR1可以磷酸化EIN2-Ser645/Ser924位点5-7,并抑制EIN2 C端蛋白的质-核穿梭;当处理乙烯时,EIN2-Ser645/Ser924位点的磷酸被去除,导致EIN2被剪切,C端的EIN2在核内富集5-7,从而诱导乙烯相关的下游基因的表达。通过进一步的遗传学和细胞生物学手段解析,发现分别突变隶属于以上两条信号通路的EIN2上的磷酸化位点,并不会影响另一条通路的生物学功能(图1)。
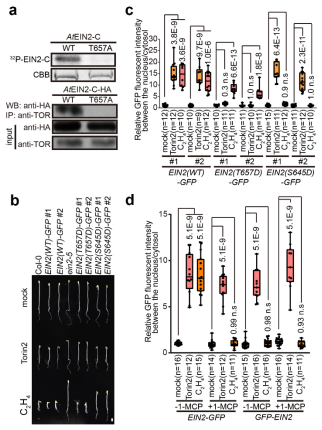
图1. TOR激酶磷酸化EIN2-Thr657位点,抑制EIN2全长蛋白的质-核穿梭
通过分析糖-EIN2调控的转录组数据,该研究组进一步发现76% 糖诱导及66% 糖抑制的基因在ein2-5突变体中表现不敏感,暗示EIN2在糖-TOR信号通路中扮演中极其关键的作用。在糖饥饿的条件下,ein2-5突变体仍然保留部分细胞分裂活性、表现出较长的根,并在一定程度上重塑糖-TOR控制的转录网络(图2)。有趣的是EIN2调控根长的表型依赖于细胞周期关键转录因子E2Fa的表达,而并不是通过传统的下游转录因子EIN3/EIL1来实现,同时该过程并不依赖于乙烯信号转导途径。这些结果说明TOR-EIN2调控植物根生长,不仅跨越了EIN2上游的乙烯信号,也不依赖于EIN2下游的转录因子EIN3/EIL1。
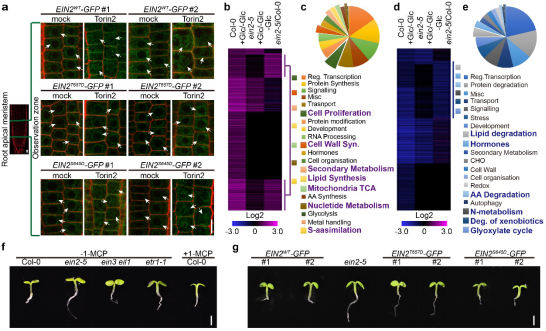
图2. 葡萄糖-TOR-EIN2调控基因转录组重编程,促进根尖快速生长
综上所述,该研究揭示了糖-TOR-EIN2信号调控下胚轴以及根生长的分子机制(图3),阐释了EIN2作为TOR激酶下游抑制因子有别于乙烯-CTR1信号的新功能。糖-TOR信号和乙烯-CTR1信号通路利用对EIN2不同磷酸化密码(位点)的调控,促使EIN2行使下游各自特异的生物学功能,提出了多功能蛋白如何响应不同上游信号来特异控制下游通路的一种可能的分子机制。
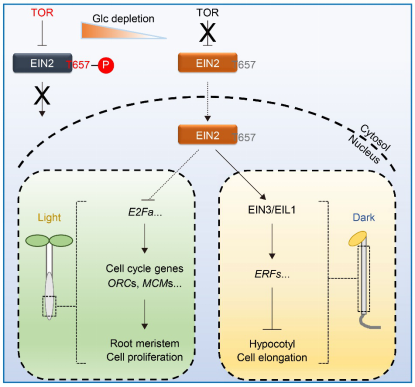
图3. 葡萄糖-TOR-EIN2通路调节下胚轴以及根的生长的工作模型
英国威廉希尔公司生命科学公司研究生导师熊延教授为该文的通讯作者。中科院上海植物逆境生物学研究中心为第一单位。英国威廉希尔公司海峡联合研究院林学中心的付力文副教授和刘岩林副教授为该论文的共同第一作者。中科院上海植物逆境生物学研究中心的秦国臣博士、訾海玲博士、徐钟天博士,韩国高丽大学生物系的Sang-Dong Yoo教授和Young-Hee Cho教授,英国威廉希尔公司海峡联合研究院农林大数据中心的刘仁义教授,国家蛋白质中心(上海)质谱设施的彭超研究员和吴萍,英国威廉希尔公司海峡联合研究院林学中心左泽乘教授及其课题组成员李亚星,北京大学药学院黄超兰教授及熊延教授团队的赵晓迪、王玥及杨书慧同学参与了本项研究。该研究得到了国家自然科学基金,中国科学院以及英国威廉希尔公司的经费资助。
参考文献
1. Liu, G. Y. & Sabatini, D. M. mTOR at the nexus of nutrition, growth, ageing and disease. 21, 183-203, doi:10.1038/s41580-019-0199-y (2020).
2.Fu, L., Wang, P. & Xiong, Y. Target of Rapamycin signaling in plant stress responses. Plant Physiology182, 1613-1623, doi:10.1104/pp.19.01214 (2020).
3.Xiong, Y. et al. Glucose-TOR signalling reprograms the transcriptome and activates meristems. Nature496, 181-186, doi:10.1038/nature12030 (2013).
4.Li, X. et al. Differential TOR activation and cell proliferation in Arabidopsis root and shoot apexes. Proceedings of the National Academy of Sciences114, 2765-2770, doi:10.1073/pnas.1618782114 (2017).
5.Q.iao, H. et al. Processing and subcellular trafficking of ER-tethered EIN2 control response to ethylene gas. Science (New York, N.Y.)338, 390-393, doi:10.1126/science.1225974 (2012).
6.Ju, C. et al. CTR1 phosphorylates the central regulator EIN2 to control ethylene hormone signaling from the ER membrane to the nucleus in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America109, 19486-19491, doi:10.1073/pnas.1214848109 (2012).
7.Wen, X. et al. Activation of ethylene signaling is mediated by nuclear translocation of the cleaved EIN2 carboxyl terminus. Cell research22, 1613-1616, doi:10.1038/cr.2012.145 (2012).

