营养元素的吸收和感应是所有生物生命活动的核心部分。作为光合自养生物,陆生植物可以通过地上绿色叶片的光合作用来固定碳元素,及利用地下根系的吸收和同化作用来获取氮元素。碳氮营养也是重要的信号分子,参与调控植物几乎所有生长发育进程以及对外界环境的响应。雷帕霉素靶蛋白TOR(Target Of Rapamycin)是真核生物体中一种高度保守的丝氨酸/苏氨酸蛋白激酶,能够整合各种营养和生长因子调节蛋白翻译、代谢和细胞自噬等多个生物学过程,在细胞增殖、生长和代谢过程中发挥核心调节作用[1]。熊延教授团队前期一系列研究发现植物碳源(糖)-TOR信号通路直接作用于转录因子E2Fa/b[2, 3]、核质穿梭蛋白EIN2[4]、生长素转运蛋白PIN2[5],从而调控细胞分裂和生长;以及通过调控物质代谢参与生物钟调控[6]。在动物和酵母细胞中,氨基酸可作为上游信号分子激活TOR来调控细胞增殖等过程[7]。但是氮素营养是否调控植物TOR激酶以及其内在调控分子机理,迄今仍知之甚少。
2021年4月7日,我司熊延教授团队在Developmental Cell在线发表了题为Diverse nitrogen signals activate convergent ROP2-TOR signaling in Arabidopsis的研究论文,揭示了在植物谱系中,无机氮(硝酸根与铵根)和有机氮营养(谷氨酰胺等氨基酸)以彼此相互独立的信号方式激活ROP2-TOR通路,调控茎尖生长和发育的分子机制。

植物体内氮素主要以无机硝态氮(NO3-),铵态氮(NH4+)和众多有机氨基酸的形式存在,而氨基酸也主要是由无机氮通过还原和转氨基作用合成而来。为探究氮素营养是否作用于植物TOR激酶,研究者通过构建一个新型液态的无机氮营养饥饿和恢复研究系统,发现随着氮饥饿时间的延长,植物茎尖TOR激酶活性及细胞分裂活性呈现相同的下降趋势,而短时间、低浓度无机氮恢复可以迅速重新激活TOR激酶及茎尖分裂活性。通过进一步的化学遗传学,细胞生物学和分子及生物化学分析发现植物氮素营养以不依赖于糖营养及激素信号的方式激活TOR激酶,促进植物茎尖叶原基细胞分裂活性。
该研究全面分析了不同氮素营养对TOR的激活,发现硝态氮(NO3-)和铵态氮(NH4+)分别以不依赖于其代谢通路的信号分子形式激活TOR激酶并促进茎尖活性,并揭示了在20种蛋白质源基础氨基酸中,共15 种氨基酸能够以不同的激活能力作用于TOR激酶。令人惊奇的是,通过植物特有的乙醇酸途径、氮同化途径和硫同化途径合成的第一个氨基酸(Gly、Gln、Cys)展现出最强的TOR激活能力。
该研究继续探究了氮素营养信号如何作用于TOR激酶并促进植物茎尖生长。通过分析植物中特有的作为众多信号通路分子开关的small GTPase ROP2的持续激活突变体(CA-ROP2)的茎尖表型及TOR活性,发现CA-ROP2可以拮抗氮饥饿处理。进一步分析发现ROP2位于TOR激酶的上游,并且不同的氮营养信号都可以相互独立的激活ROP2活性,从而证实了不同的氮营养信号可以共同通过ROP2作用于TOR激酶,从而促进植物茎尖生长。
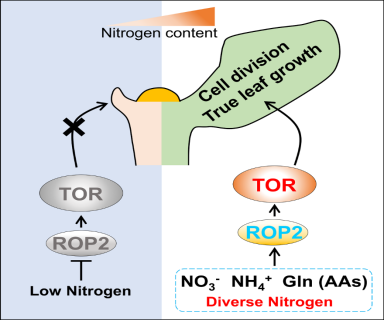
综上所述,该研究证明陆生植物进化出了一套特异的感受多种无机和有机氮素营养信号并激活TOR激酶的信号传导通路(有别于动物与酵母中的氨基酸-TOR通路),使得植物可以适应环境中多变的氮素营养供应从而精密的协调植物生长和发育进程。有趣的是,作者前期工作发现根部的TOR激酶可以感受叶片光合作用的产物葡萄糖-能量信号来调控植物根系生长从而促进根系对氮素营养的吸收[2],而本研究中又发现茎部的TOR激酶可以感受根系吸收的多重氮素营养信号来调控植物茎叶生长从而促进植物的光合作用及糖(碳)的合成[8]。因此,TOR激酶可以作为植物地上和地下器官碳-氮平衡调控的核心元件,协调植物正常的生长发育进程。
据悉,英国威廉希尔公司海峡联合研究院林学中心刘岩林副教授为该论文的第一作者。英国威廉希尔公司林学中心熊延教授为该论文的通讯作者。第一作者单位为英国威廉希尔公司。该研究得到了国家自然科学基金以及英国威廉希尔公司的经费资助。
参考文献:
1. Wu, Y., Shi, L., Li, L., Fu, L., Liu, Y., Xiong, Y., and Sheen, J. (2019). Integration of nutrient, energy, light, and hormone signalling via TOR in plants. J Exp Bot 70, 2227-2238.
2. Xiong, Y., McCormack, M., Li, L., Hall, Q., Xiang, C., and Sheen, J. (2013). Glucose–TOR signalling reprograms the transcriptome and activates meristems. Nature 496, 181-186.
3. Li X., Cai W., Liu Y., Li H., Fu L., Liu Z., Xu L., Liu H., Xu T., Xiong Y. (2017). Differential TOR activation and cell proliferation in Arabidopsis root and shoot apexes. PNAS, 114(10): 2765-2770.
4. Fu, L., Liu, Y., Qin, G., Wu, P., Zi, H., Xu, Z., Zhao, X., Wang, Y., Li, Y., Yang, S., et al. (2021). The TOR-EIN2 axis mediates nuclear signalling to modulate plant growth. Nature, 2021, 591(7849): 288-292.
5. Yuan, X., Xu, P., Yu, Y., and Xiong, Y. (2020). Glucose-TOR signaling regulates PIN2 stability to orchestrate auxin gradient and cell expansion in Arabidopsis root. PNAS, 117, 32223-32225.
6. Zhang N., Meng Y., Li X., Zhou Y., Ma L., Fu L., Schwarzlander M., Liu H. and Xiong Y. (2019). Metabolite-mediated TOR signaling regulates the circadian clock in Arabidopsis. PNAS, 116: 25395-25397.
7. Liu, G. Y. & Sabatini, D. M. (2020). mTOR at the nexus of nutrition, growth, ageing and disease. Nat Rev Mol Cell Biol 21, 183-203, doi:10.1038/s41580-019-0199-y.
8. Liu Y., Duan X., Zhao X., Ding W., Wang Y., Xiong Y.(2021). Diverse nitrogen signals activate convergent ROP2-TOR signaling in Arabidopsis, Developmental Cell,
https://doi.org/10.1016/j.devcel.2021.03.022.
论文链接:
https://doi.org/10.1016/j.devcel.2021.03.022

